Sistem disperesi adalah pencampuran secara nyata antara dua zat atau lebih di mana zat yang jumlahnya lebih sedikit disebut dengan fase terdispersi dan zat yang jumlahnya lebih banyak disebut medium pendispersi. Berdasarkan ukuran fase terdispersinya, system dipersi dibedakan menjadi tiga, yaitu : larutan sejati, koloid dan suspensi. Sifat dari masing masing system disperse tersebut adalah
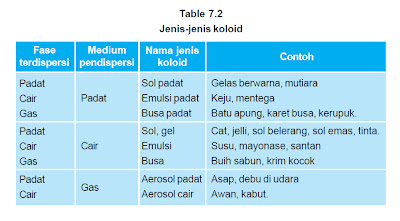
Berdasarkan jenis fase terdispersi dan medium pendispersinya dikenal delapan macam system koloid,
yaitu :
SIFAT-SIFAT KOLOID
Koloid mempunyai sifat yang khas diantaranya yaitu,
1. Efek Tyndal
- Peristiwa penghamburan cahaya oleh partikel koloid
- Penyebabnya : ukuran yang dimiliki oleh partikel koloid
efek Tyndall
2. Gerak Brown
- Gerak lurus tak beraturan (zig-zag) dari partikel koloid dalam medium pendispersi
- Terjadi akibat tabrakan antara partikel koloid dengan mendium pendispersinya
- Gerak semakin cepat jika ukuran partikel koloid semakin kecil
- Gerak Brown menyebabkan system koloid bersifat stabil
- Semakin kecil ukuran partikel koloid, semakin cepat gerak Brown yang terjadi.
- Semakin besar ukuran partikel koloid, semakin lambat gerak Brown yang terjadi.
Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak ditemukan dalam campuran heterogen zat cair dengan zat padat (suspensi). Gerak Brown juga dipengaruhi oleh suhu.
Semakin tinggi suhu sistem koloid, maka semakin besar energi kinetik yang dimiliki partikel-partikel medium pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah suhu sistem koloid, maka gerak Brown semakin lambat.
gerak brown
3. Elektroforesis
- adalah pergerakan koloid di bawah pengaruh medan listrik.
- partikel koloid data bermuatan listrik karena terjadi penyerapan ion pada permukaan
- Manfaat Elektroforesis
a. Untuk menentukan muatan partikel koloid
b. Untuk memproduksi barang barang industri yang terbuat dari karet
c. Untuk mengurangi zat pencemar udara yang dikeluarkan dari cerobong asap pabrik dengan alat yang disebut Cottrel
pengendap cottrel
4. Adsorpsi
- Adalah proses penyerapan suatu zat di permukaan zat lain.
- Zat yang diserap disebut fase terserap dan zat yang menyerap disebut adsorben.
- disebabkan karena gaya tarik molekul-molekul pada permukaan adsorpen.
- Pemanfaatan adsorpsi dalam kehidupan sehari-hari antara lain :
adsorbsi
a. Proses pemutihan gula pasir
Gula yang masih berwarna dilarutkan ke dalam air kemudian dialirkan melalui tanah diatomae dan arang tulang. Zat- warna dalam gula akan diadsorpsi sehingga diperoleh gula yang putih dan bersih.
b. Penyembuhan sakit perut dengan serbuk karbon atau norit
Norit adalah tablet yang terbuat dari karbon aktif. Jika diminum, di dalam usus norit membentuk sistem koloid yang dapat mengadsorpsi gas atau racun
c. Penjernihan air keruh dengan menggunakan tawa (Al2(SO4)3)
Dengan menambahkan tawas atau aluminium sulfat ke dalam air, aluminium sulfat akan terhidrolisis membentuk Al(OH)3 yang berupa koloid yang dapat mengadsorpsi zat-zat warna atau zat pencemar dalam air.
d. Penggunaan arang aktif
- Penggunaan arang halus pada masker, berfungsi untuk menyerap gas yang beracun
- Filter pada rokok, yang berfungsi untuk mengikat asap nikotin dan tar
5. Koagulasi
- peristiwa pengendapan atau penggumpalan partikel koloid
- terjadi karena kerusakan stabilitas system koloid atau karena penggabungan partikel koloid yang berbeda muatan.
- terjadi dalam 3 cara :
a. Mekanik, yakni dengan pengadukan, pemanasan dan pendinginan
Contoh:
– Darah merupakan sol butir-butir darah merah dalam plasma darah, bila dipanaskan akan menggumpal.
– Agar-agar akan menggumpal bila didinginkan.
b. Penambahan elektrolit
Koloid yang bermuatan negatif akan menarik ion positif (kation), sedangkan koloid yang bermuatan positif akan menarik ion negatif (anion). Ion-ion tersebut akan membentuk selubung lapisan ke dua. Apabila selubung lapisan kedua ini terlalu dekat maka selubung ini akan menetralkan muatan koloid sehingga terjadi
koagulasi. Makin besar muatan ion makin kuat daya menariknya dengan partikel koloid, sehingga makin cepat terjadi koagulasi.
c. Pencampuran koloid yang berbeda muatan
d. elektroforesis
Dengan sel elektroforesis. Apabila arus listrik dialirkan cukup lama ke dalam sel elektroforesis, maka partikel koloid akan digumpalkan ketika mencapai elektrode. Koloid yang bermuatan negative akan digumpalkan di anode, sedangkan koloid bermuatan positif digumpalkan di katode.
- Proses Koagulasi dalam kehidupan sehari-hari terjadi pada : perebusan telur, perebusan tahu, pembuatan lateks, proses penjernihan air, pembentukan delta di muara sungai, pengolahan asap atau debu.
6. Koloid Pelindung
- system koloid yang ditambahkan pada koloid lain agar diperoleh koloid yang stabil
- contoh : gelatin yang digunakan pada pembuatan es krim untuk mencegah
pembentukan kristal es yang keras dan kasar
7. Dialisis
- proses penghilangan ion-ion penggangu kestabilan koloid dengan menggunakan selaput Semipermeabel.
- Selaput semipermeabel adalah selaput yang hanya dapat dilewati oleh ion dan air, tetapi tidak dapat dilewati oleh partikel koloid.
- Aplikasi dalam kehidupan : Dalam proses cuci darah penderita gagal ginjal, proses dialisis
Berfungsi untuk menghilangkan urea dari darah.
proses dialisis
8. Koloid Liofil dan Liofob
- Koloid Liofil : koloid yang partikelnya menarik (suka) medium pendispersinya.
Contoh : agar-agar, lem, kanji, gelatin
- Koloid Liofob : koloid yang tidak menarik (tidak suka) medium pendispersinya.
Contoh : koloid logam
Sifat hidrofob dan hidrofil dimanfaatkan dalam proses pencucian pakaian pada penggunaan detergen. Apabila kotoran yang menempel pada kain tidak mudah larut dalam air, misalnya lemak dan minyak.dengan bantuan sabun atau detergen maka minyak akan tertarik oleh detergen. Oleh karena detergen larut dalam air, akibatnya minyak dan lemak dapat tertarik dari kain.
Kemapuan detergen menarik lemak dan minyak disebabkan pada molekul detergen terdapat ujung-ujung liofil yang larut dalam air dan ujung liofob yang dapat menarik lemak dan minyak. Akibat adanya tarik-menarik tersebut , tegangan permukaan lemak dan minyak dengan kain menjadi turun dehingga lebih kuat tertarik oleh molekul-molekul air yang mengikat kuat detergen.
Proses Penarikan lemak dan minyak oleh detergen
CARA PEMBUATAN KOLOID
1. Cara Kondensasi
- Dilakukan dengan cara menggabungkan atau mengumpulkan molekul atau ion dari larutan sejati menjadi partikel koloid
- Dapat dilakukan melalui :
a. Reaksi Redoks
Reaksi yang disertai perubahan bilangan oksidasi. Koloid yang terjadi merupakan hasil oksidasi atau reduksi.
Contoh:
1. Pembuatan sol belerang dari reaksi antara hidrogen sulfida (H2S) dengan beleran dioksida (SO2), yaitu dengan mengalirkan gas H2S ke dalam larutan SO2.
2H2S(g) + SO2(aq) ------> 2H2O(l) + 3S(s)
2. Pembuatan Sol Emas
AuCl3 (aq) + 3 FeSO4 (aq) -------> Au (s) + Fe2(SO4)3 (aq) + FeCl3 (aq)
b. Reaksi Hidrolisis
Hidrolisis adalah reaksi suatu zat dengan air. Reaksi ini umumnya digunakan untuk membuat koloid-koloid basa dari suatu garam yang dihidrolisis.
Contoh:
Pembuatan sol Fe(OH)3 dari hidrolisis FeCl3. Dengan cara memanaskan larutan FeCl3 (apabila ke dalam air mendidih ditambahkan larutan FeCl3 akan terbentuk sol Fe(OH)3.
FeCl3(aq) + 3H2O → Fe(OH)3(s) + 3HCl(aq)
c. Reaksi Penggaraman
AgNO3 (aq) + NaCl (aq) -----> AgCl (s) + NaNO3 (aq)
d. Pertukaran ionReaksi pertukaran ion umumnya dilakukan untuk membuat koloid dari zat-zat yang sukar larut (endapan) yang dihasilkan pada reaksi kimia.
Contoh:
Pembuatan sol As2S3 dengan mengalirkan gas H2S ke dalam larutan As2O3 dengan reaksi berikut.
3H2S(g) + As2O3(aq) As2S3(s) + 3H2O(l)
2. Cara Dispersi
- Proses mengubah partikel kasar menjadi partikel koloid.
- Dilakukan melalui :
a. Cara mekanik (penggerusan)
Butir-butir kasar diperkecil ukurannya dengan menggiling atau menggerus koloid sampai diperoleh tingkat kehalusan tertentu, kemudian diaduk dengan medium pendispersi.
Contoh:
Sol belerang dibuat dengan menggerus serbuk belerang bersama-sama suatu zat inert (seperti gula pasir) kemudian mencampur serbuk halus itu dengan air.
b. cara peptisasi (penambahan ion sejenis dalam endapan)
Dengan cara memecah partikel-partikel besar menjadi partikel koloid, misalnya suspensi, gumpalan atau endapan dengan bantuan suatu zat pemeptisasi (pemecah).
Contoh:
* Agar-agar dipeptisasi oleh air, nitroselulaosa oleh aseton, karet oleh bensin, dan lainlain.
* Endapan NiS dipeptisasi oleh H2S dan endapan Al(OH)3 oleh AlCl3.
c. cara busur bredig (cara listrik)
Cara ini digunakan untuk membuat sol-sol logam. Logam yang akan dikoloidkan dijadikan elektrode yang dicelupkan ke dalam medium dispersi. Kemudian diberi arus listrik yang cukup kuat sehingga terjadi loncatan bunga api listrik di antara kedua ujungnya.
Mula-mula atom-atom logam akan terlempar ke dalam air, kemudian atomatom tersebut mengalami kondensasi sehingga menjadi partikel koloid. Cara ini merupakan gabungan cara dispersi dan kondensasi.
d. Homogenisasi
Dengan menggunakan mesin homogenisasi.
Contoh:
– emulsi obat di pabrik obat dilakukan dengan proses homogenisasi.
– Pembuatan susu kental manis yang bebas kasein dilakukan dengan mencampurkan serbuk susu skim ke dalam air dengan menggunakan mesin homogenisasi.
Sifat koloid yang terpenting adalah muatan partikel koloid. Semua partikel koloid memiliki muatan sejenis (positif atau negatif). Dikarenakan muatan yang sejenis, maka terdapat gaya tolak-menolak antar partikel koloid. Hal ini mengakibatkan partikel-partikel koloid tidak dapat bergabung sehingga memberikan kestabilan pada sistem koloid, tetapi secara keseluruhan, sistem koloid bersifat netral karena partikel-partikel koloid bermuatan ini akan menarik ion-ion dengan muatan berlawanan dalam medium pendispersinya.
(i) Sumber Muatan Koloid Sol
Partikel-partikel koloid mendapat muatan listrik melalui 2 cara, yaitu:
a). Proses Adsorpsi
Partikel koloid dapat mengadsopsi partikel bermuatan dari fase pendispersinya. Akibatnya, partikel koloid bermuatan. Jenis muatannya tergantung dari jenis partikel bermuatan yang diserap, apakah berupa kation atau anion. Untuk dapat mengerti lebih jelas, simaklah gambar di bawah ini.
Partikel sol Fe(OH)3 (bermuatan positif) mempunyai kemampuan untuk mengadsorpsi kation dari medium pendispersinya sehingga bermuatan positif, sedangkan partikel sol As2S3 (bermuatan negatif) mengadsorpsi anion dari medium pendispersinya sehingga bermuatan negatif.
Partikel koloid sol tidak selalu mengadsorpsi ion yang sama tetapi dapat berbeda tergantung jenis ion berlebih (kation atau anion) dari medium pendispersinya. Contohnya, sol AgCl dalam medium pendispersi dengan kation Ag + berlebih akan mengadsorpsi Ag + sehingga bermuatan positif dan sebaliknya, jika anion Cl- berlebih, maka sol AgCl akan mengadsorpsi ion Cl- sehingga bermuatan negatif.

b). Proses Ionisasi Gugus Permukaan Partikel
Beberapa partikel koloid memperoleh muatan dari proses ionisasi gugus-gugus yang ada pada permukaan partikel koloid. Contohnya adalah koloid protein dan koloid sabun atau deterjen.
(ii) Kestabilan Koloid
Muatan partikel-partikel koloid adalah sejenis sehingga cenderung saling tolak-menolak. Gaya tolak-menolak ini mencegah partikel-partikel koloid bergabung dan mengendap akibat gaya gravitasi, sehingga muatan koloid berperan besar dalam menjaga kestabilan koloid.
(iii) Lapisan Bermuatan Ganda
Permukaan partikel koloid mendapat muatan listrik dengan mengadsorpsi ion dari medium pendispersinya. Lapisan bermuatan listrik ini selanjutnya akan menarik ion-ion dengan muatan berlawanan dari medium pendispersinya. Akibatnya, akan terbentuk 2 lapisan yang disebut lapisan permukaan ganda. Adanya lapisan ini menyebabkan sistem koloid secara keseluruhan bersifat netral.
(iv) Elektroforesis
Oleh karena partikel koloid sol bermuatan listrik, maka partikel ini akan bergerak dalam medan listrik. Pergerakkan partikel koloid dalam medan listrik disebut elektroforesis.
Dalam tabung U yang berisi sistem koloid sol yang bermuatan positif, dimasukkan sepasang elektrode dan diberi arus searah dari sumber tegangan. Dapat diketahui bahwa partikel-partikel koloid bermuatan positif tersebut bergerak menuju elektrode dengan muatan berlawanan, yaitu elektrode negatif (katode). Apabila sistem koloid tersebut diganti dengan yang bermuatan negatif, maka akan ditemukan bahwa partikel-partikel koloid akan bergerak menuju elektrode positif (anode). Fenomena eletroforesis dapat digunakan untuk menentukan jenis muatan partikel koloid.

Muatan beberapa partikel koloid dalam medium pendispersi air:

nb. maaf untuk penulisan rumus kimia tidak memenuhi aturan yg seharusnya dikarenakan kendala teknis.
#gak tau gmna bkin biar bsa subscript sma superscript









Tidak ada komentar:
Posting Komentar